(1)業許可とは
医療機器は大きく4つに分類されますが、その生体への影響度が高いという性格から、誰でも製造や販売ができる訳ではありません。医薬品医療機器等法(旧称 薬事法)では医療機器を製造・販売するための許可制度を設けており、その業許可がないと医療機器を取り扱うことができないことになっています。
(2)医療機器製造業とは
医療機器製造販売業者の委託を受け、製品の製造を行なう者です。認められているのは製造だけであって医療機器製造販売業者のように医療機器の承認申請をしたり、医療機器を医療機器販売業者に売ったりすることはできません。製造した製品は医療機器製造販売業者または医療機器製造業者にのみ販売・賃貸・授与することができ、医療機器販売業者およびエンドユーザーへの販売は行なうことができません。
つまり、医療機器製造業者の責任範囲は『製造した医療機器を製造販売業者に出荷するまで』ということになります。なお、医療機器製造業の許可は下記のように区分されています。
| 生物区分 | 生物品目(細胞組織医療機器と特定生物由来製品)の製造工程の全部又は一部を行なうもの |
|---|---|
| 滅菌区分 | 製造工程において滅菌される医療機器(生物区分のものを除く)の製造工程の全部又は一部を行なうもの(包装等区分のものを除く) |
| 一般区分 | 生物区分・滅菌区分の医療機器以外の医療機器の製造工程の全部又は一部を行なうもの(包装等区分のものを除く) |
| 包装等区分 | 滅菌区分、一般区分の医療機器の製造工程のうち、包装、表示又は、保管のみを行なうもの |
構造設備の要件として、<生物区分・滅菌区分>は作業室の独立性、汚染防止、床、窓に関することなど厳しい要件となっています。
<一般区分>は必要な面積と器具があり、清潔で、手洗い・更衣室があること、<包装等区分>は必要な面積と器具があり清潔であること等々が求められています。
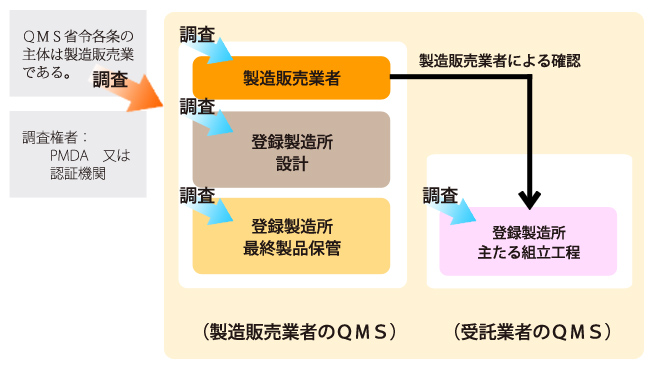
医療機器製造業における「製造管理および品質管理の基準」は、QMS省令の適合が許可要件になっています。QMS省令は、ISO13485:2003(医療機器の品質保証の国際規格)の規格に準拠し、医薬品医療機器等法(旧称 薬事法)の法規制に適合するように構築されたものです。
| クラス分類 | QMS省令が適用される医療機器 | |
|---|---|---|
| 高度管理医療機器 | クラスⅢ・クラスⅣ | 全ての医療機器 |
| 管理医療機器 | クラスⅡ | 全ての医療機器 |
| 一般医療機器 | クラスⅠ | 厚生労働省告示440号で指定された医療機器 製造工程で滅菌される医療機器 |
(3)医療機器製造販売業とは
医療機器製造販売業とは、自らは製造行為(表示、自社外での補完行為も製造に含まれる)を行なわないが、製品の出荷を行なうと同時に医療機器の製品についての流通責任を負う者のことです。品質(製造)だけでなく、安全(情報)についても積極的に収集・分析・評価を行い、必要な措置を講じなければなりません。
さらには、医療機器の「承認」や「認証」も製造販売業者が書類を揃えて申請し、審査等を申請する役割を担います。製造販売業者が製品の薬事申請者となり安全・品質管理責任を負うので、医療機器の製造において最も重要な役割を果たしていると言えます。
なお、医薬品医療機器等法(旧称薬事法)第2条第12項では、製造等(他に委託して製造する場合を含み、他から委託を受けて製造する場合を含まない)をし、又は輸入した医療機器を販売し、賃貸し、又は授与するもののことをいう、と定められています。
QMS省令という基準に従って製造管理・品質管理を行い、GVPという基準に基づき安全管理ができる体制が整っていることが、許可取得の要件になっています。
製造販売業者は、自ら製造所を持っていることもありますが、必ずしも自社製造である必要はありません。
製造所・工場が子会社(別法人)であってもよいですし、専門の技術を持つ製造業者に製造委託することも可能です。
また、医療機器製造販売業の許可も下記の通り区分されており、区分に応じて取り扱えるクラスが異なります。
| 医療機器の分類 | 医療機器の種類 | クラス分類 | リ ス ク | 解 説 | 具体的な機器類 |
|---|---|---|---|---|---|
| 第一種医療機器製造 販売業許可 | 高度管理医療機器 | クラスⅣ | きわめて 高 | 患者への侵襲度が高く、不具合が生じた場合、生命の危機に直結する恐れが あるもの | 心臓ペースメーカ 人工心臓弁、ステント等 |
| 同 上 | 同 上 | クラスⅢ | 高 | 不具合が生じた場合、人体へのリスクが比較的高いと考えられるもの | 放射線治療装置、人工骨、バルーンカテーテル、透析器等 |
| 第二種医療機器製造 販売業許可 | 管理医療機器 | クラスⅡ | 中 | 不具合が生じた場合でも、 人体へのリスクが比較的低い と考えられるもの | 家庭用電位治療器、歯科材料、家庭用低周波治療器、X線装置、消化器用カテーテル等 |
| 第三種医療機器製造 販売業許可 | 一般医療機器 | クラスⅠ | 低 | 不具合が生じた場合でも、 人体へのリスクが極めて低い と考えられるもの | ピンセット、電動式患者台、X線フィルム、歯科技工用用品等 |
医療機器の承認、認証、届出
クラスに応じた手続き
医療機器を製造販売するにあたっては、医療機器のクラスに応じて、製造販売承認又は認証を申請して承認/認証を取得するか、製造販売に先立って製造販売届を提出する必要があります。
| クラス分類 | 承認・認証 ・届出 | 審査機関 | |||
| クラスIV (高度管理医療機器) | 承認 | PMDA | |||
| クラスIII (高度管理) | 認証基準が存在しない | 承認 | PMDA | ||
| 同 上 | 認証基準が適合しない | 承認 | PMDA | ||
| 同 上 | 認証基準に適合する (=指定管理医療機器 | 認証 | 認証機関 | ||
| クラスII (管理) | 認証基準が存在しない | 承認 | PMDA | ||
| 同 上 | 認証基準が適合しない | 承認 | PMDA | ||
| クラスI (一般医療機器) | 認証基準に適合する (=指定管理医療機器) | 認証 | 認証機関 |
クラス1の医療機器(一般医療機器)は、独立行政法人医薬品医療機器総合機構(PMDA)に製造販売届書を提出します。
例外的に、新医療機器にあたる場合のみ、PMDA に製造販売承認申請をすることになります。
クラス2(管理医療機器)又はクラス3(高度管理医療機器)で、認証基準に適合するものは、国に登録された認証機関(民間の株式会社や財団等)に製造販売認証申請を行います。認証機関は、製品が認証基準に適合していること等を審査します。
上記以外はPMDAに対して製造販売承認申請を行います。承認申請は、新医療機器、改良医療機器(臨床あり、臨床なし)、後発医療機器という申請区分があります。
承認申請書、認証申請書
医療機器の承認申請や認証申請を行うにあたって、承認申請書、認証申請書及び添付資料等を提 出します。
申請書類には、医療機器の使用目的や効果、形状、構造、原理、原材料、性能、安全性規格、使用方法、保管方法や有効期間、製造所(製造業登録を受けている製造所とその製造所で担当する工程等)外観など、医療機器を特定する内容を示します。
また、医療機器は全て「基本要件基準」という基準に適合していることが求められているため、基本要件基準に適合することを示す資料などを作成し、添付します。
こうした書類が、PMDA や認証機関によって審査されます。
一般医療機器の場合は(新医療機器で承認申請が必要な場合を除き)、医療機器を特定する製造販売届書を PMDA に提出しますが、その内容について審査がありません。
なお、承認申請、認証申請、製造販売届は、医療機器の製造販売業者が行います(外国の医療機器メーカーが自社の名前で申請し承認又は認証を得たい場合を除く)。
(4)医療機器販売業・賃貸業とは
医療機器販売業・賃貸業とは、医療機器製造販売業者より供給された医療機器を、直接又は他の販売業経由で医療機関等のユーザーに提供するもののことを言います。販売業においては、高度管理医療機器または特定保守管理医療機器を販売する場合は許可の取得が、また管理医療機器については、都道府県への届出が義務化されています。
販売業の許可申請又は届出に際しては、営業所の構造設備・営業管理者の設置が許可(届出)の要件になります。なお、賃貸業についても同様の要件となります。
| 許可 | 高度管理 | 許可 | 営業管理者の設置義務 | 営業管理者の従事年数1年 | 許可 | 営業管理者が取扱可能な範囲制限無し |
| 高度管理 医療機器 | コンタクト レンズ | 許可 | 営業管理者はコンタクト管理医療器のみ取り扱いが可能 | 営業管理者の従事年数1年 | 営業管理者の研修義務 | 営業管理者はコンタクト管理医療器のみ取り扱いが可能 |
(5)医療機器修理業とは
医療機器は修理に関しても、医療機器修理業の業許可を持っている者しか取り扱うことができません。医療機関等からの修理品を医療機器修理業者が修理する場合、まず修理に着手するまでに医療機器製造販売業者に文書で修理する医療機器の品名、製造番号、故障内容を通知して、医療機器製造販売業者から修理指示を受けなければなりません。医療機器修理業者はその指示に基づいて修理を行なうことになります。
医療機器修理業の許可は、特定保守管理医療機器(特管)と特定保守管理医療機器以外の医療機器(非特管)に分かれ、区分ごと、事業所ごとに許可が与えられます。特定保守管理医療機器については、特に品質と安全性を確保するため許可要件や遵守事項が厳しくなっています。
(6)外国製造業者認定とは
外国より日本に輸出される医薬品、医療機器または医薬部外品を製造しようとする者を外国製造業者といいます。この場合、日本の医療機器製造業者の許可と同様に、外国製造業者になろうとする者は医薬品医療機器等法(旧称薬事法)第13条の3による認定を受けることで製造ができるようになります。
これは、外国にある企業等には日本の薬事法を適用することができないため、国内の医療機器製造業者の「許可」に対し、外国での製造については認定制度を設け、製造業を許可したとみなす制度です。外国製造業の有効期限も、同様に5年となります。なお、認定区分(特定生物由来、滅菌、一般、包装・表示・保管)や構造設備等の要件については、医療機器製造業と同様のものが求められます。
さらに、販売の承認を得るにあたっては、医療機器製造販売業者を選任する必要があり、医療機器製造販売業者は申請の代行に加え、通常の医療機器製造販売業者としての責務を負うことになります。
(7)医療機器 業許可の種類・区分と許可要件 まとめ
| 業種 | 区分 | 行為 | 許可要件 | 有効 期限 |
|---|---|---|---|---|
| 製造 販売業 | 第一種 | 高度管理医療機器まで全て製造販売 | ・人的要件 (総括、品責、安責) ・GVP (製造販売後の安全管理) ・GQP (品質管理) | 5年 |
| 製造 販売業 | 第二種 | 管理医療機器まで製造販売 | ・人的要件 (総括、品責、安責) ・GVP (製造販売後の安全管理) ・GQP (品質管理) | |
| 製造 販売業 | 第三種 | 一般医療機器のみを製造販売 | ・人的要件 (総括、品責、安責) ・GVP (製造販売後の安全管理) ・GQP (品質管理) | |
| 製造業 | 一般 | 製造工程の全部又は一部 | ・人的要件 (責任技術者) ・構造設備 ・(QMS) ※許可要件ではないが 品目申請の際に必要 | 5年 |
| 製造業 | 滅菌 | 滅菌医療機器の製造工程の全部又は一部 | ・人的要件 (責任技術者) ・構造設備 ・(QMS) ※許可要件ではないが 品目申請の際に必要 | 5年 |
| 製造業 | 特定生物由来 | 特定生物由来製品の製造工程の全部又は一部 | ・人的要件 (責任技術者) ・構造設備 ・(QMS) ※許可要件ではないが 品目申請の際に必要 | 5年 |
| 製造業 | 表示・保管等 | 表示・包装及び保管のみを行なう | ・人的要件 (責任技術者) ・構造設備 ・(QMS) ※許可要件ではないが 品目申請の際に必要 | 5年 |
| 販売業 | 高度管理 | 高度管理医療機器まで全て販売 | ・人的要件 (販売管理者) ・構造設備 | 6年 |
| 販売業 | 管理 | 管理医療機器まで販売 | ・人的要件 (販売管理者) ・構造設備 | - |
